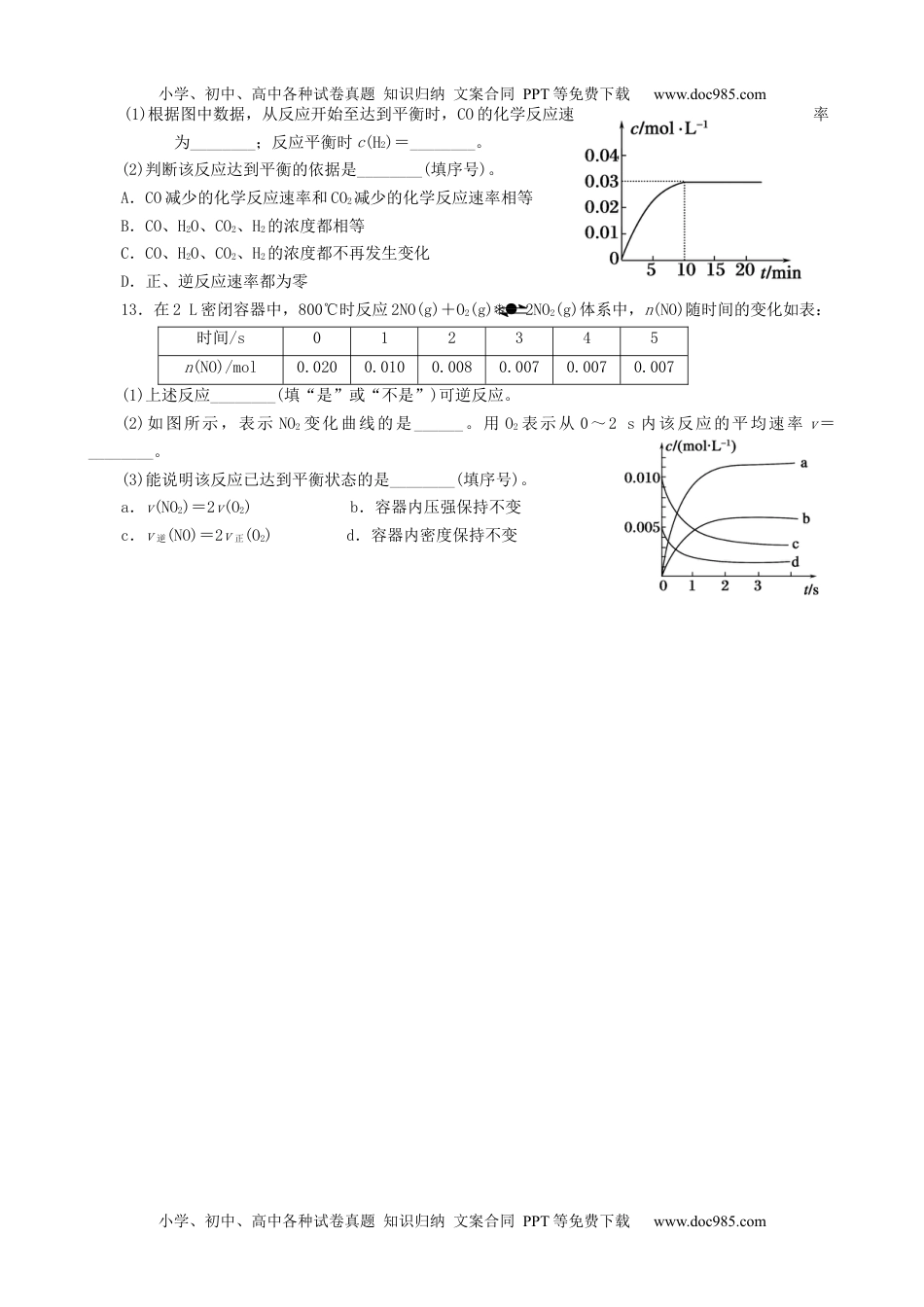
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com《化学反应速率与限度》练习一、选择题1.将5.6g铁粉投入足量的100mL2mol/L稀硫酸中,2min时铁粉刚好完全溶解。下列有关这个反应的反应速率表示正确的是()A.铁的反应速率=0.5mol/(L·min)B.硫酸的反应速率=0.5mol/(L·min)C.硫酸亚铁的反应速率=1mol/(L·min)D.氢气的反应速率=0.5mol/(L·min)2.某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2min后,测得参加反应的X2为0.6mol/L,用Y2的变化表示的反应速率v(Y2)=0.1mol/(L·min),生成的c(Z)为0.4mol/L,则该反应的化学方程式是()A.X2+2Y22XY2B.2X2+Y22X2YC.3X2+Y22X3YD.X2+3Y22XY33.下列说法正确的是()A.密闭容器中充入1molN2和3molH2可生成2molNH3B.一定条件下,可逆反应达到平衡状态,该反应就达到了这一条件下的最大限度C.对于任何反应增大压强,化学反应速率均增大D.化学平衡是一种动态平衡,条件改变,原平衡状态不会被破坏4.在一定温度时,将1molA和2molB放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)C(g)+2D(g),经5min后,测得容器内B的浓度减少了0.2mol·L-1。则下列叙述不正确的是()A.在5min内该反应用C的浓度变化表示的反应速率为0.02mol·(L·min)-1B.在5min时,容器内D的浓度为0.2mol·L-1C.该可逆反应随反应的进行,容器内压强逐渐增大D.5min时容器内气体总的物质的量为3mol5.将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法正确的是()①用物质A表示的反应的平均速率为0.3mol·L-1·s-1②用物质B表示的反应的平均速率为0.6mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol·L-1A.①③B.①④C.②③D.③④6.可逆反应2NO2(g)2NO(g)+O2(g)在体积固定的密闭容器中,达到平衡状态的标志是()①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时生成2nmolNO③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部7.在2L的密闭容器中进行如下反应:mX(g)pZ(g)+qQ(g)在2秒钟内用X表示的平均反应速率为mol/(L·s),则2秒钟内Q物质增加了()A.molB.molC.molD.mol8.一定温度下,在容积为1L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列表述中正确的是()A.该反应的化学方程式为2MNB.t2时,正、逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍9.对于可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列说法正确的是()A.达到化学平衡时,4v正(O2)=5v逆(NO)B.若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态C.达到平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大D.化学反应速率关系是:2v正(NH3)=3v正(H2O)10.向等质量的a、b两份锌粉中,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是二、填空题11.t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g),2min时反应达到平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:(1)从反应开始到化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。(2)下列叙述能说明该反应已达到化学平衡状态的是________。A.容器内压强不再发生变化B.SO2的体积分数不再发生变化C.容器内气体原子总数不再发生变化D.相同时间内消耗2nmolSO2的同时消耗nmolO2E.相同时间内消耗2nmolSO2的同时生成nmolO2(3)t℃时,若...