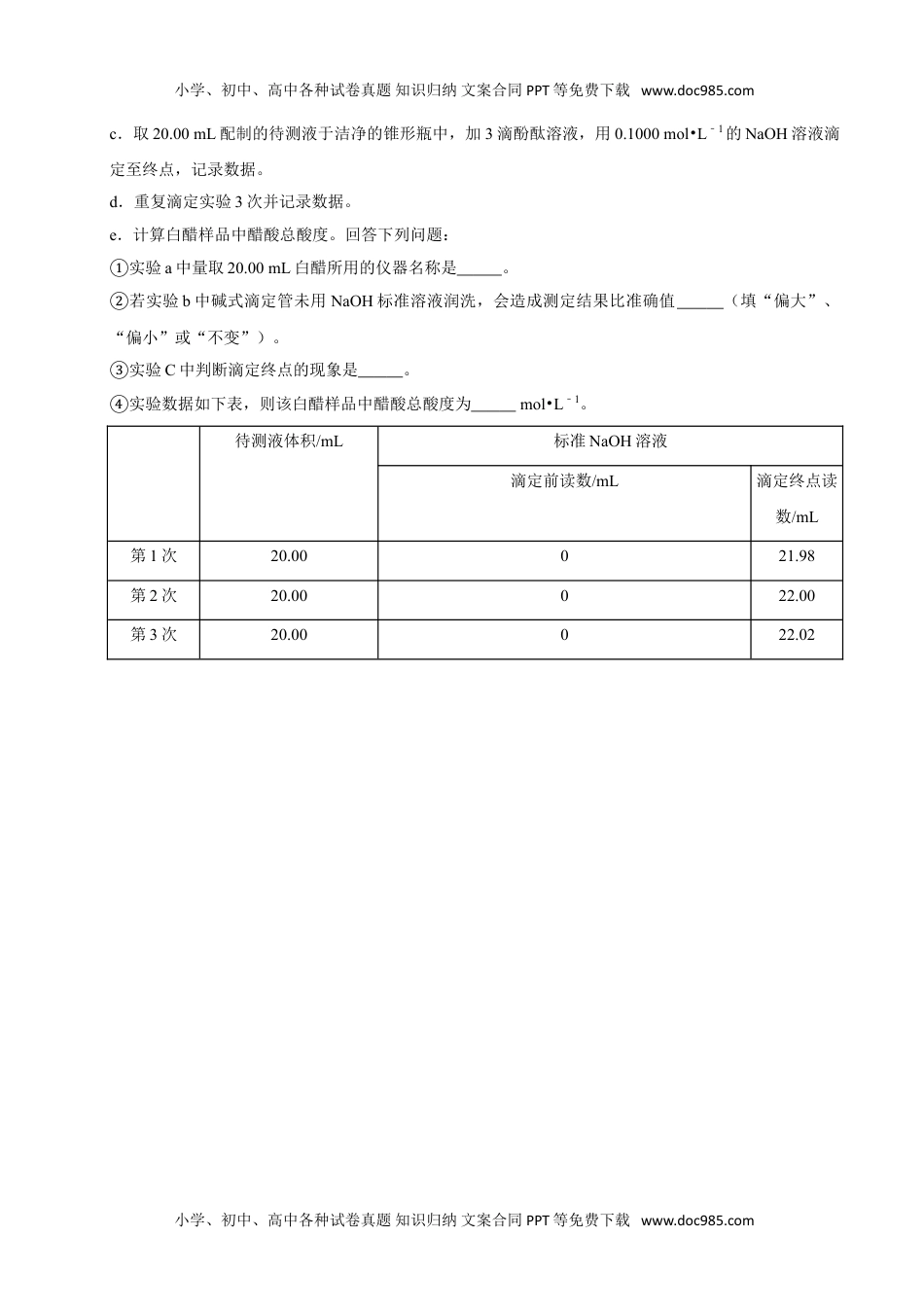
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第一单元物质及其变化第二节离子反应(一)一、基础巩固1.下列物质属于非电解质,但其水溶液能导电的是()A.BaSO4B.SO2C.NaOHD.Cl22.既不是电解质,又不是非电解质的是()A.氯气B.二氧化硫C.酒精D.冰醋酸3.下列有关电解质的说法正确的是()A.强电解质一定是离子化合物B.易溶性强电解质的稀溶液中不存在溶质分子C.强电解质溶液的导电能力一定比弱电解质强D.由于硫酸钡难溶于水,所以硫酸钡是弱电解质4.能发生离子反应,但是不会产生沉淀的是()A.澄清石灰水中通入CO2B.NaHCO3溶液中滴加NaOH溶液C.Na2CO3溶液中滴加NaOH溶液D.氯化钠溶液中滴加硝酸银溶液5.下列各项操作中发生“先产生沉淀,然后沉淀又溶解”现象的是()①向澄清石灰水中逐渐通入CO2至过量②向NaAlO2溶液中逐渐通入CO2至过量③向AlCl3溶液中逐滴加入NaOH至过量④向硅酸钠溶液中逐滴加入盐酸至过量⑤向Fe(OH)3胶体中逐滴加入稀盐酸至过量⑥向Ca(ClO)2溶液中逐渐通入CO2至过量A.①③B.①②⑤C.①③⑤⑥D.①②⑥6.下列方程式正确的是()小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.NaHS的电离:NaHS═H++S2﹣+Na+B.NaHCO3的水解:HCO3﹣+H2O═H3O++CO32﹣C.HF的电离:HF+H2O═H3O++F﹣D.(NH4)2SO4的电离:(NH4)2SO4═2NH4++SO42﹣7.根据题设的条件判断离子共存情况。A:Na+、Cu2+、SO42﹣、Cl﹣B:H+、Cl﹣、CO32﹣、Na+C:H+、Cl﹣、Fe3+、NO3﹣D:CH3COO﹣、H+、Na+、SO42﹣E:Al3+、Ag+、Cl﹣、NO3﹣F:NH4+、Na+、S2﹣、ClO﹣(1)因生成沉淀而不能共存的是;(2)因生成弱电解质而不能共存的是;(3)因生成气体而不能共存的是。二、拓展提升8.写出下列反应的化学方程式:(1)Na2O2与CO2反应;(2)将氯气与通入冷的消石灰中反应制漂白粉;(3)将铜粉溶解在浓FeCl3溶液中:;(4)向FeCl3溶液中滴加氨水:。9.写出下列过程的离子反应方程式:(1)向氯化铝溶液中加入少量氨水:。(2)用强碱溶液吸收工业废气中的NO2:(3)氯化铁溶液的水解反应:。10.电解质的水溶液中存在电离平衡。(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是(填字母序号)。a.滴加少量浓盐酸b.微热溶液c.加水稀释d.加入少量醋酸钠晶体(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。a.量取20.00mL白醋样品,用100mL容量瓶配制成待测液。b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comc.取20.00mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000mol•L﹣1的NaOH溶液滴定至终点,记录数据。d.重复滴定实验3次并记录数据。e.计算白醋样品中醋酸总酸度。回答下列问题:①实验a中量取20.00mL白醋所用的仪器名称是。②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值(填“偏大”、“偏小”或“不变”)。③实验C中判断滴定终点的现象是。④实验数据如下表,则该白醋样品中醋酸总酸度为mol•L﹣1。待测液体积/mL标准NaOH溶液滴定前读数/mL滴定终点读数/mL第1次20.00021.98第2次20.00022.00第3次20.00022.02小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com