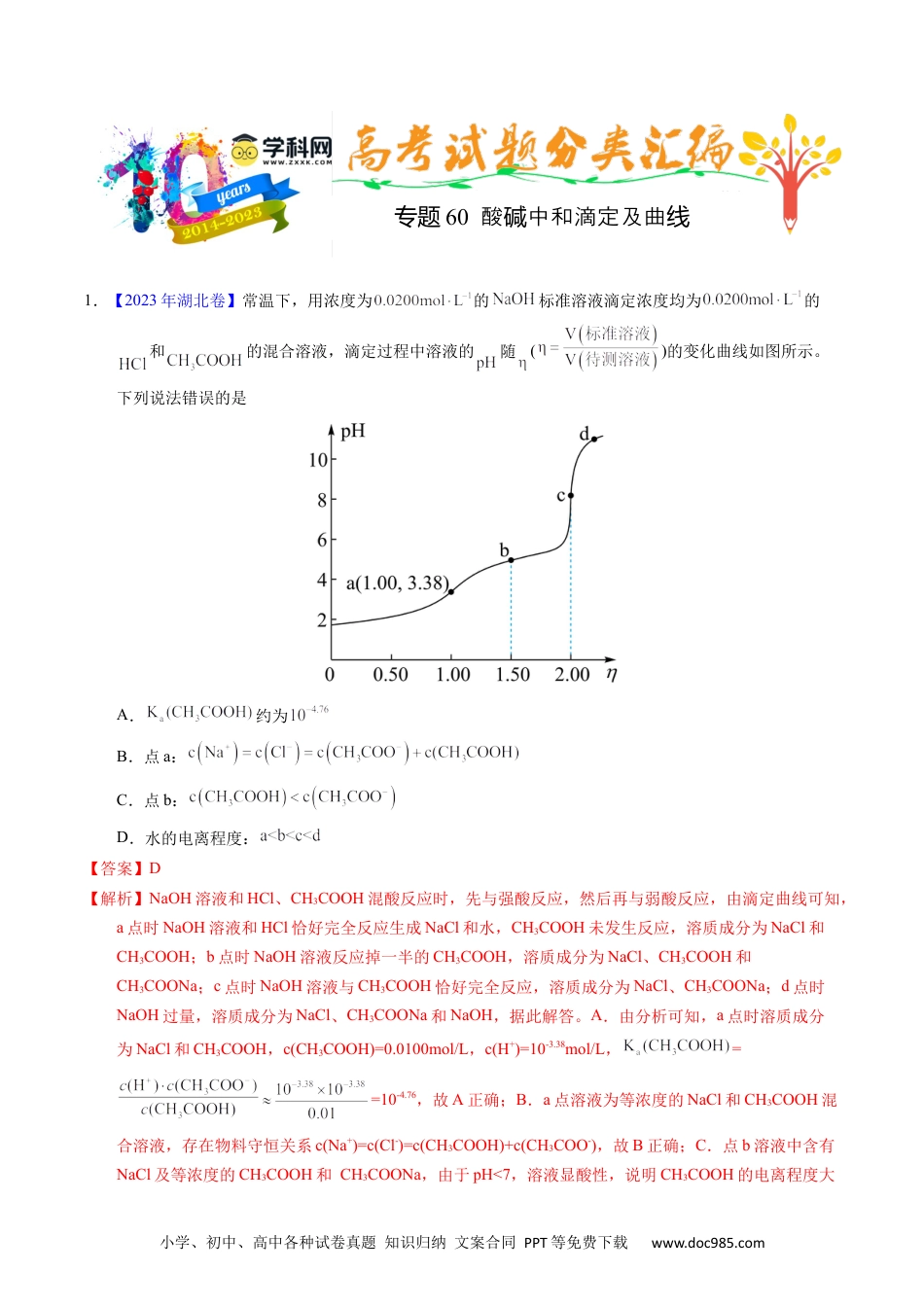
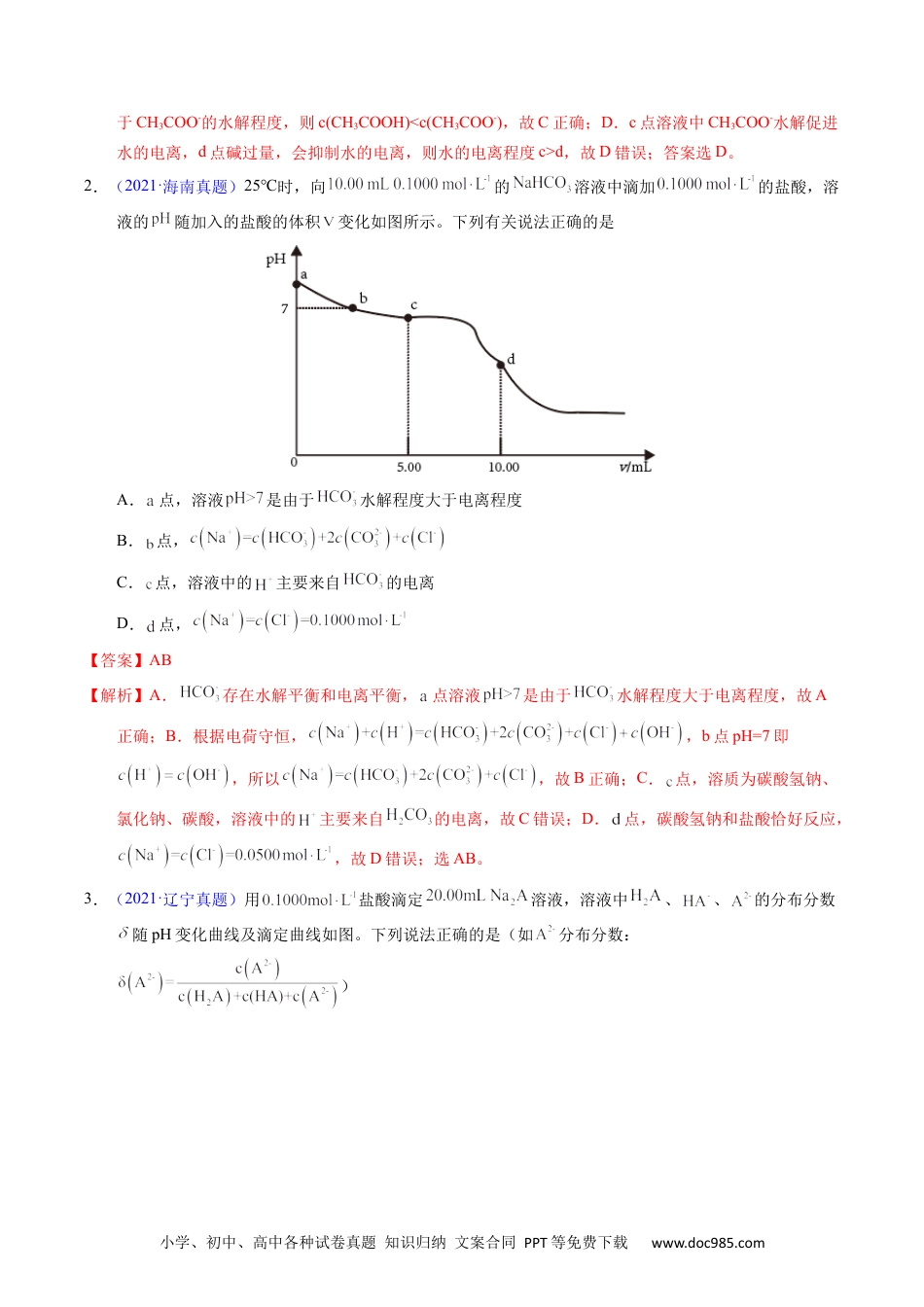
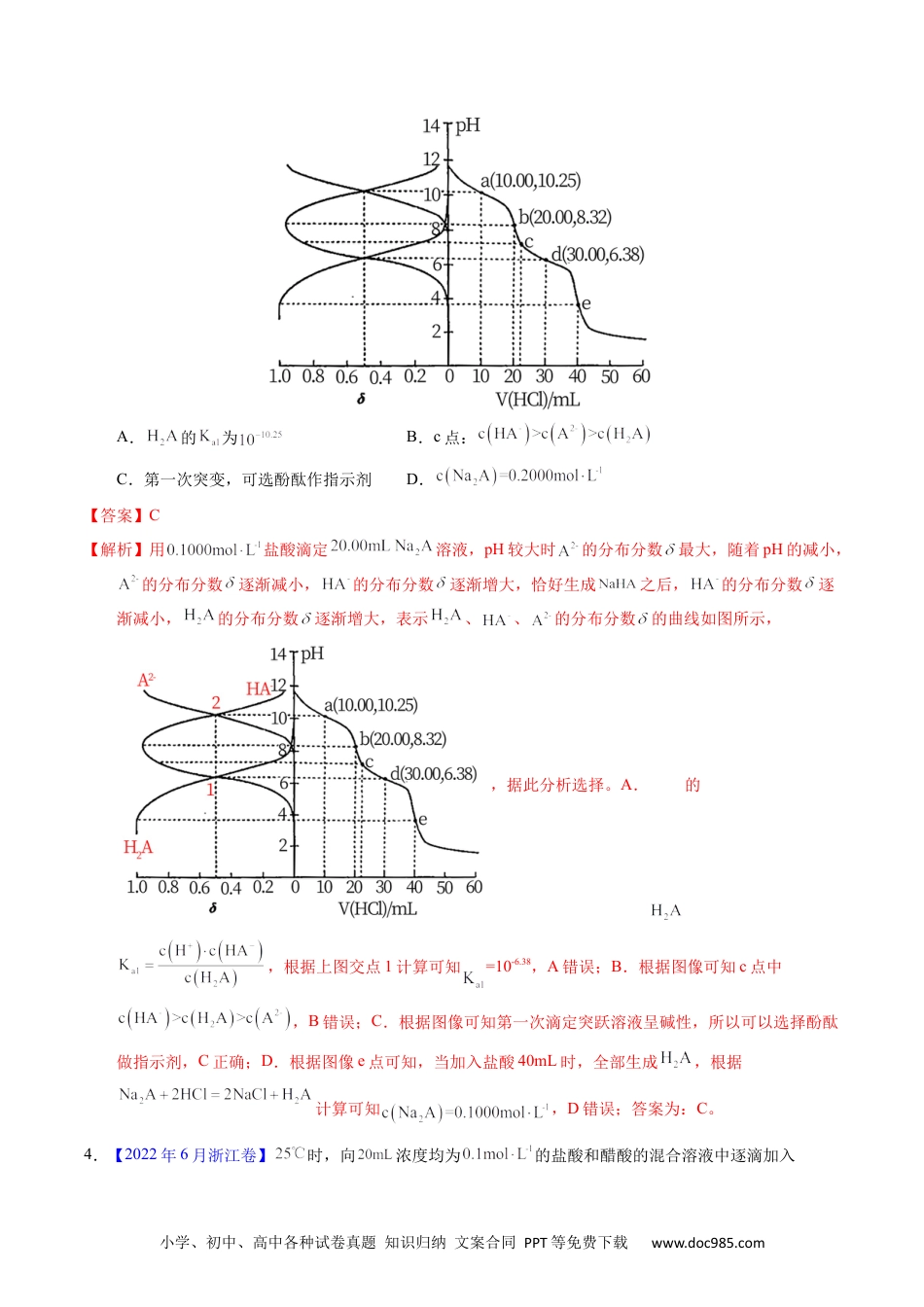
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.【2023年湖北卷】常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是A.约为B.点a:C.点b:D.水的电离程度:【答案】D【解析】NaOH溶液和HCl、CH3COOH混酸反应时,先与强酸反应,然后再与弱酸反应,由滴定曲线可知,a点时NaOH溶液和HCl恰好完全反应生成NaCl和水,CH3COOH未发生反应,溶质成分为NaCl和CH3COOH;b点时NaOH溶液反应掉一半的CH3COOH,溶质成分为NaCl、CH3COOH和CH3COONa;c点时NaOH溶液与CH3COOH恰好完全反应,溶质成分为NaCl、CH3COONa;d点时NaOH过量,溶质成分为NaCl、CH3COONa和NaOH,据此解答。A.由分析可知,a点时溶质成分为NaCl和CH3COOH,c(CH3COOH)=0.0100mol/L,c(H+)=10-3.38mol/L,==10-4.76,故A正确;B.a点溶液为等浓度的NaCl和CH3COOH混合溶液,存在物料守恒关系c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-),故B正确;C.点b溶液中含有NaCl及等浓度的CH3COOH和CH3COONa,由于pH<7,溶液显酸性,说明CH3COOH的电离程度大专题60酸中和滴定及曲碱线小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com于CH3COO-的水解程度,则c(CH3COOH)<c(CH3COO-),故C正确;D.c点溶液中CH3COO-水解促进水的电离,d点碱过量,会抑制水的电离,则水的电离程度c>d,故D错误;答案选D。2.(2021·海南真题)25℃时,向的溶液中滴加的盐酸,溶液的随加入的盐酸的体积变化如图所示。下列有关说法正确的是A.点,溶液是由于水解程度大于电离程度B.点,C.点,溶液中的主要来自的电离D.点,【答案】AB【解析】A.存在水解平衡和电离平衡,点溶液是由于水解程度大于电离程度,故A正确;B.根据电荷守恒,,b点pH=7即,所以,故B正确;C.点,溶质为碳酸氢钠、氯化钠、碳酸,溶液中的主要来自的电离,故C错误;D.点,碳酸氢钠和盐酸恰好反应,,故D错误;选AB。3.(2021·辽宁真题)用盐酸滴定溶液,溶液中、、的分布分数随pH变化曲线及滴定曲线如图。下列说法正确的是(如分布分数:)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.的为B.c点:C.第一次突变,可选酚酞作指示剂D.【答案】C【解析】用盐酸滴定溶液,pH较大时的分布分数最大,随着pH的减小,的分布分数逐渐减小,的分布分数逐渐增大,恰好生成之后,的分布分数逐渐减小,的分布分数逐渐增大,表示、、的分布分数的曲线如图所示,,据此分析选择。A.的,根据上图交点1计算可知=10-6.38,A错误;B.根据图像可知c点中,B错误;C.根据图像可知第一次滴定突跃溶液呈碱性,所以可以选择酚酞做指示剂,C正确;D.根据图像e点可知,当加入盐酸40mL时,全部生成,根据计算可知,D错误;答案为:C。4.【2022年6月浙江卷】时,向浓度均为的盐酸和醋酸的混合溶液中逐滴加入小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com的溶液(醋酸的;用的溶液滴定等浓度的盐酸,滴定终点的突跃范围4.3~9.7)。下列说法不正确的是A.恰好中和时,溶液呈碱性B.滴加溶液至的过程中,发生反应的离子方程式为:C.滴定过程中,D.时,【答案】B【解析】A.恰好中和时,生成氯化钠溶液和醋酸钠溶液,其中醋酸根离子会水解,溶液显碱性,A正确;B.滴加溶液至的过程中,若只发生反应的离子方程式:,则滴加NaOH溶液的体积为20mL,则根据电离常数,的醋酸中,c(H+)≈c(CH3COO-)===>1.0×10-4.3,故用氢氧化钠滴定的过程中,醋酸也参加了反应,则离子方程式为:H++OH-=H2O和CH3COOH+OH-=CH3COO-+H2O,B错误;C.滴定前盐酸和醋酸的浓度相同,故滴定过程中,根据物料守恒可知:,C正确;D.向浓度均为的盐酸和醋酸的混合溶液中逐滴加入的溶液,当盐酸的体积为20ml时,溶液为氯化钠和醋酸的混合溶液,显酸性,需要再滴加适量的氢氧化钠,当加入的NaOH溶液的体积为30mL时,溶液为NaCl和等浓度的CH3COONA.CH3COOH,根据Ka=1.8×10-5>Kh=可知,此时溶液仍然呈酸性,需继续滴加NaOH溶液,故有,D正确;故答案为...