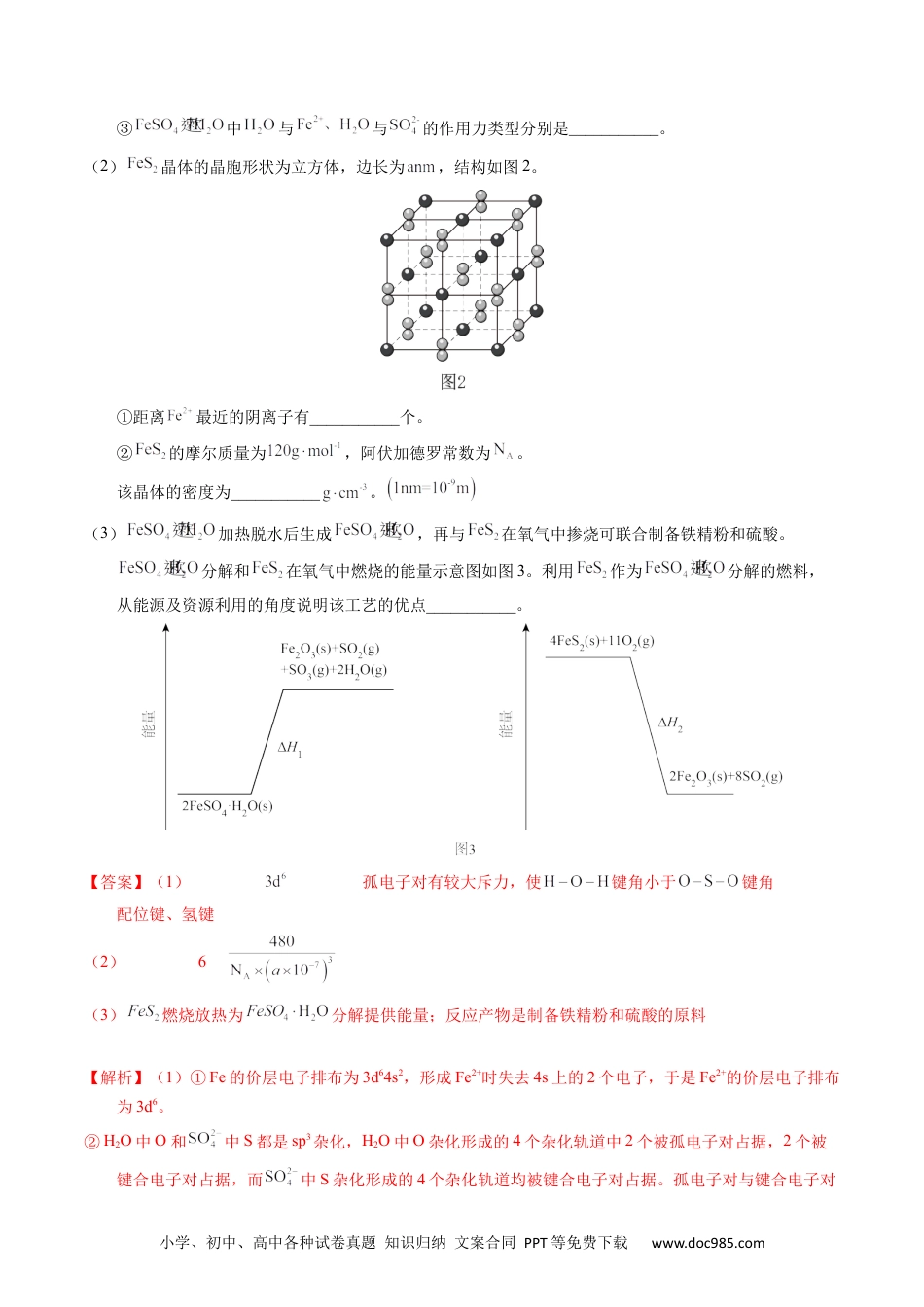
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.【2023年全国乙卷】中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为,铁的化合价为。(2)已知一些物质的熔点数据如下表:物质熔点/℃800.7与均为第三周期元素,熔点明显高于,原因是。分析同族元素的氯化物、、熔点变化趋势及其原因。的空间结构为,其中的轨道杂化形式为。(3)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有个。该物质化学式为,B-B最近距离为。【答案】(1)O>Si>Fe>Mg+2(2)钠的电负性小于硅,氯化钠为离子晶体,而为分子晶体随着同族元素的电子层数的增多,其熔点依次升高,其原因是:、、均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大正四面体(3)1专题37物合质结构综——以金元素主体属为小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com【解析】(1)为26号元素,基态原子的价电子排布式为。元素的金属性越强,其电负性越小,元素的非金属性越强则其电负性越大,因此,橄榄石()中,各元素电负性大小顺序为O>Si>Fe>Mg;因为中、、的化合价分别为+2、+4和-2,x+2-x=2,根据化合物中各元素的化合价的代数和为0,可以确定铁的化合价为+2。(2)与均为第三周期元素,熔点明显高于,原因是:钠的电负性小于硅,氯化钠为离子晶体,其熔点较高;而为分子晶体,其熔点较低。由表中的数据可知,、、熔点变化趋势为:随着同族元素的电子层数的增多,其熔点依次升高,其原因是:、、均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大。的空间结构为正四面体,其中的价层电子对数为4,因此的轨道杂化形式为。(3)由硼镁化合物的晶体结构可知位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有个,由晶胞沿c轴的投影图可知本题所给晶体结构包含三个晶胞,则晶胞中Mg的个数为1;晶体结构中在正六棱柱体内共6个,则该物质的化学式为;由晶胞沿c轴的投影图可知,B原子在图中两个正三角形的重心,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长度为,因此B-B最近距离为。2.【2022年北京卷】工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)结构示意图如图1。①的价层电子排布式为___________。②中O和中S均为杂化,比较中键角和中键角的大小并解释原因___________。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com③中与与的作用力类型分别是___________。(2)晶体的晶胞形状为立方体,边长为,结构如图2。①距离最近的阴离子有___________个。②的摩尔质量为,阿伏加德罗常数为。该晶体的密度为___________。(3)加热脱水后生成,再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点___________。【答案】(1)孤电子对有较大斥力,使键角小于键角配位键、氢键(2)6(3)燃烧放热为分解提供能量;反应产物是制备铁精粉和硫酸的原料【解析】(1)①Fe的价层电子排布为3d64s2,形成Fe2+时失去4s上的2个电子,于是Fe2+的价层电子排布为3d6。②H2O中O和中S都是sp3杂化,H2O中O杂化形成的4个杂化轨道中2个被孤电子对占据,2个被键合电子对占据,而中S杂化形成的4个杂化轨道均被键合电子对占据。孤电子对与键合电子对小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com间的斥力大于键合电子对与键合电子对间的斥力,使得键角与键角相比被压缩减小。③H2O中O有孤电子对,Fe2+有空轨道,二者可以形成配位键。中有电负性较大的O元素可以与H2O中H元素形成氢键。答案为:3d6;孤电子对有较大斥力,...