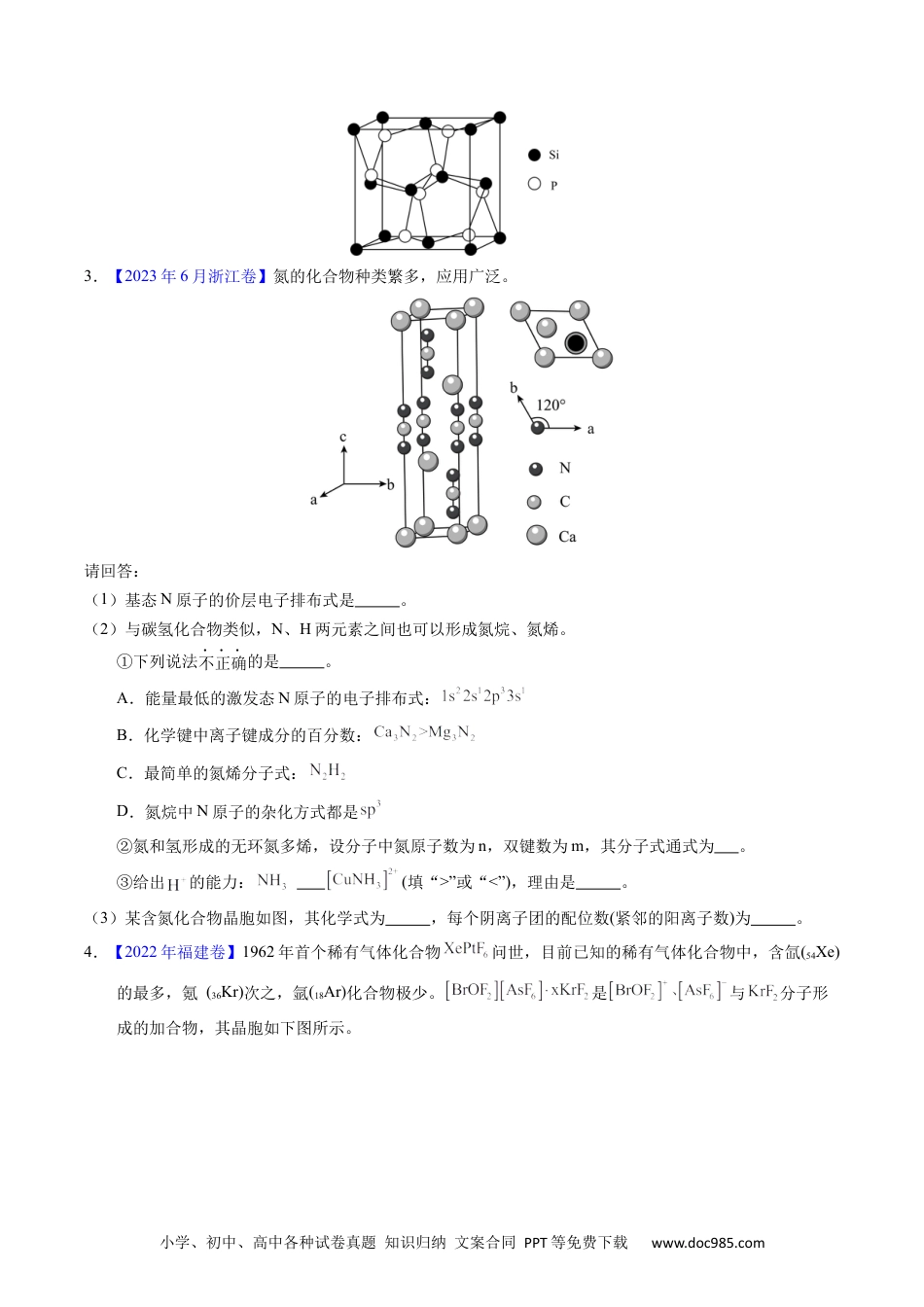
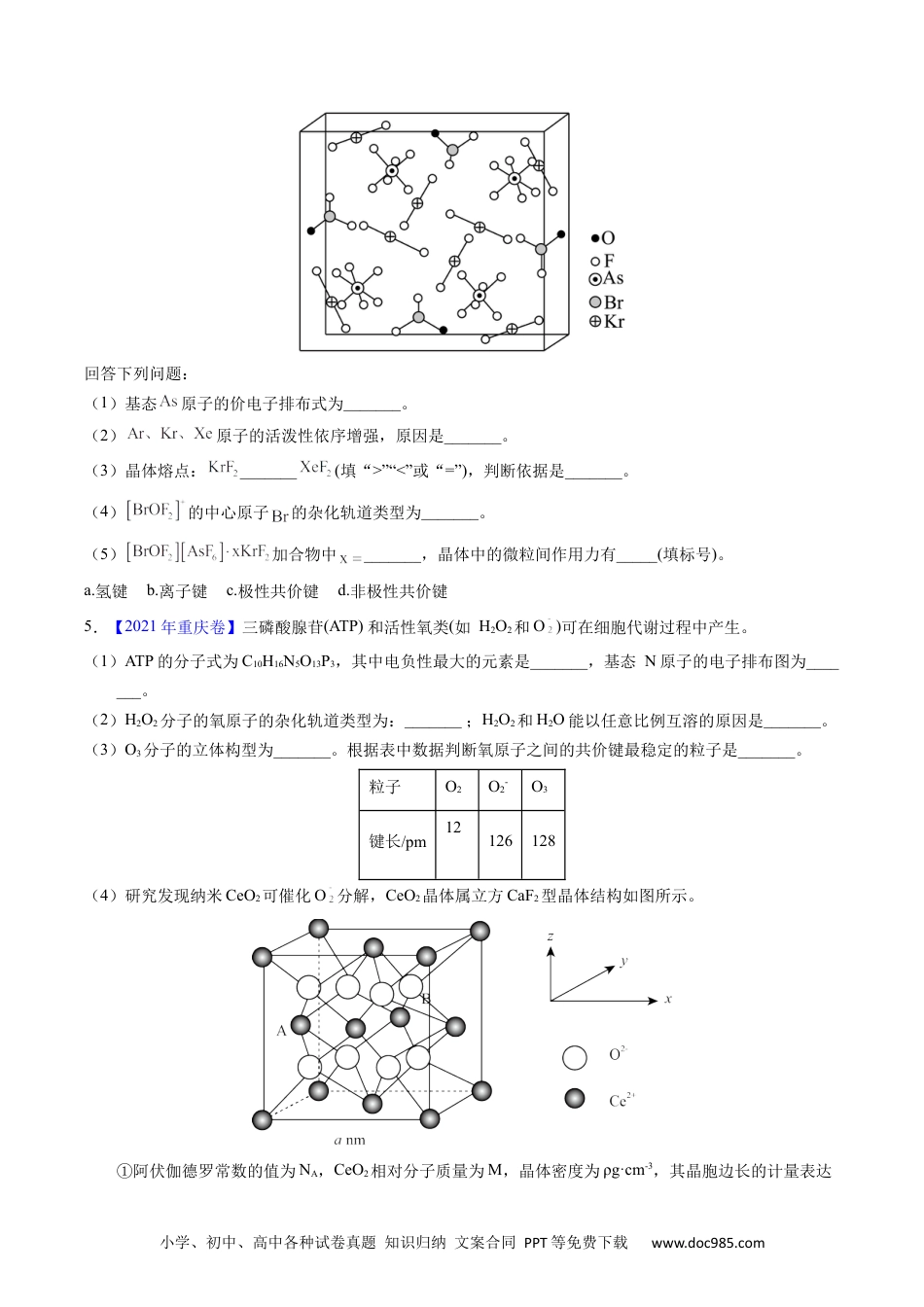
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.【2023年山东卷】卤素可形成许多结构和性质特殊的化合物。回答下列问题:(1)时,与冰反应生成利。常温常压下,为无色气体,固态的晶体类型为,水解反应的产物为(填化学式)。(2)中心原子为,中心原子为,二者均为形结构,但中存在大键。中原子的轨道杂化方式;为键角键角(填“>”“<”或“=”)。比较与中键的键长并说明原因。(3)一定条件下,和反应生成和化合物。已知属于四方晶系,晶胞结构如图所示(晶胞参数),其中化合价为。上述反应的化学方程式为。若阿伏加德罗常数的值为,化合物的密度(用含的代数式表示)。2.【2023年1月浙江卷】硅材料在生活中占有重要地位。请回答:(1)分子的空间结构(以为中心)名称为,分子中氮原子的杂化轨道类型是。受热分解生成和,其受热不稳定的原因是。(2)由硅原子核形成的三种微粒,电子排布式分别为:①、②、③,有关这些微粒的叙述,正确的是___________。A.微粒半径:③>①>②B.电子排布属于基态原子(或离子)的是:①②C.电离一个电子所需最低能量:①>②>③D.得电子能力:①>②(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是,该化合物的化学式为。专题38物合质结构综——以非金元素主体属为小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com3.【2023年6月浙江卷】氮的化合物种类繁多,应用广泛。请回答:(1)基态N原子的价层电子排布式是。(2)与碳氢化合物类似,N、H两元素之间也可以形成氮烷、氮烯。①下列说法不正确的是。A.能量最低的激发态N原子的电子排布式:B.化学键中离子键成分的百分数:C.最简单的氮烯分子式:D.氮烷中N原子的杂化方式都是②氮和氢形成的无环氮多烯,设分子中氮原子数为n,双键数为m,其分子式通式为。③给出的能力:(填“>”或“<”),理由是。(3)某含氮化合物晶胞如图,其化学式为,每个阴离子团的配位数(紧邻的阳离子数)为。4.【2022年福建卷】1962年首个稀有气体化合物问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪(36Kr)次之,氩(18Ar)化合物极少。是与分子形成的加合物,其晶胞如下图所示。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com回答下列问题:(1)基态原子的价电子排布式为_______。(2)原子的活泼性依序增强,原因是_______。(3)晶体熔点:_______(填“>”“<”或“=”),判断依据是_______。(4)的中心原子的杂化轨道类型为_______。(5)加合物中_______,晶体中的微粒间作用力有_____(填标号)。a.氢键b.离子键c.极性共价键d.非极性共价键5.【2021年重庆卷】三磷酸腺苷(ATP)和活性氧类(如H2O2和O)可在细胞代谢过程中产生。(1)ATP的分子式为C10H16N5O13P3,其中电负性最大的元素是_______,基态N原子的电子排布图为_______。(2)H2O2分子的氧原子的杂化轨道类型为:_______;H2O2和H2O能以任意比例互溶的原因是_______。(3)O3分子的立体构型为_______。根据表中数据判断氧原子之间的共价键最稳定的粒子是_______。粒子O2O2-O3键长/pm12126128(4)研究发现纳米CeO2可催化O分解,CeO2晶体属立方CaF2型晶体结构如图所示。①阿伏伽德罗常数的值为NA,CeO2相对分子质量为M,晶体密度为ρg·cm-3,其晶胞边长的计量表达小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com式为a=_______nm。②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,,),则B离子的坐标为_______。③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2anm的立方体晶粒中位于表面的Ce4+最多有_______个。6.【2022年全国甲卷】2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。回答下列问题:(1)基态F原子的价电子排布图(轨道表示式)为_______。(2)图A.B.c分别表示C.N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同...