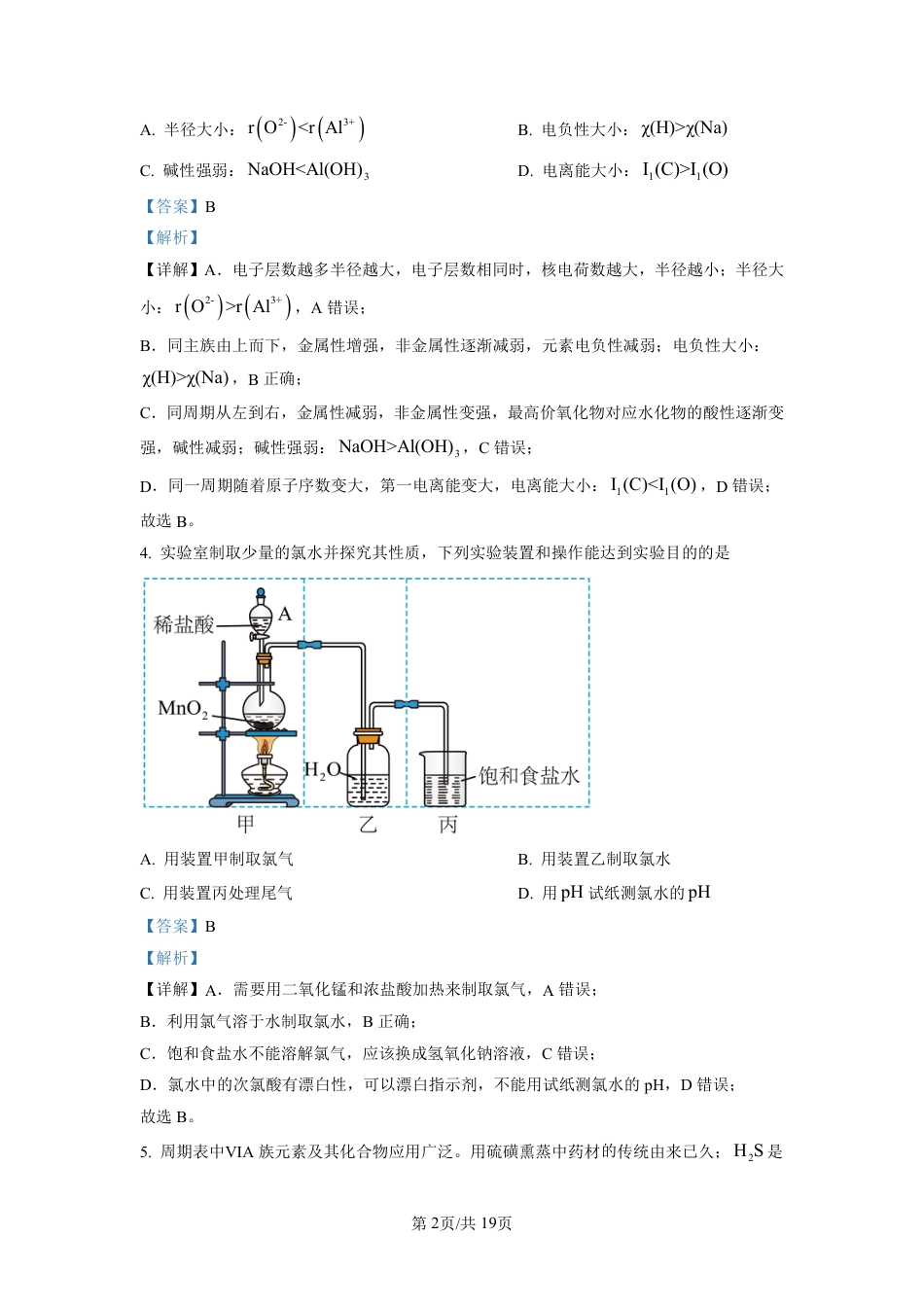
第1页/共19页(北京)股份有限公司高三化学上学期期中测试B卷-解析版化学试题可能用到的相对原子质量:H1C12N14O16K39Cr52Fe56一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。1.我国下列科技成果或其应用中涉及氧化还原反应的是A.引爆黑火药开采矿石B.用乙醚提取青蒿素C.用天然磁石造出司南D.用侯氏制碱法制取纯碱【答案】A【解析】【详解】A.引爆黑火药开采矿石,木炭、硫、硝酸钾反应生成硫化钾、氮气、二氧化碳,S、C元素化合价有变化,属于氧化还原反应,故选A;B.用乙醚提取青蒿素,属于萃取,没有生成新物质,属于物理变化,故不选B;C.用天然磁石造出司南,没有生成新物质,属于物理变化,故不选C;D.用侯氏制碱法制取纯碱,是氯化钠、二氧化碳、氨气反应生成碳酸氢钠和氯化铵,碳酸氢钠分解生成碳酸钠、二氧化碳、水,元素化合价不变,属于非氧化还原反应,故不选D;选A。2.利用反应22343CO+HO+NHNHHCO可制备碳铵。下列说法正确的是A.3NH中N元素的化合价为-3B.2HO的空间构型为直线形C.2CO的电子式为:D.43NHHCO仅含共价键【答案】A【解析】【详解】A.3NH中N元素的电负性大于H,N元素化合价为-3,故A正确;B.2HO中O成2个,有2对孤电子对,采取sp3杂化,2HO的空间构型为V形,故B错误;C.2CO的结构式为O=C=O,故C错误;D.43NHHCO是离子化合物,含有离子键和共价键,故D错误;故答案为A3.向2NaAlO溶液中滴加适量3NaHCO溶液可生成3Al(OH)沉淀。下列说法正确的是第2页/共19页(北京)股份有限公司A.半径大小:2-3+rO<rAlB.电负性大小:χ(H)>χ(Na)C.碱性强弱:3NaOH<Al(OH)D.电离能大小:11I(C)>I(O)【答案】B【解析】【详解】A.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;半径大小:2-3+rO>rAl,A错误;B.同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;电负性大小:χ(H)>χ(Na),B正确;C.同周期从左到右,金属性减弱,非金属性变强,最高价氧化物对应水化物的酸性逐渐变强,碱性减弱;碱性强弱:3NaOH>Al(OH),C错误;D.同一周期随着原子序数变大,第一电离能变大,电离能大小:11I(C)<I(O),D错误;故选B。4.实验室制取少量的氯水并探究其性质,下列实验装置和操作能达到实验目的的是A.用装置甲制取氯气B.用装置乙制取氯水C.用装置丙处理尾气D.用pH试纸测氯水的pH【答案】B【解析】【详解】A.需要用二氧化锰和浓盐酸加热来制取氯气,A错误;B.利用氯气溶于水制取氯水,B正确;C.饱和食盐水不能溶解氯气,应该换成氢氧化钠溶液,C错误;D.氯水中的次氯酸有漂白性,可以漂白指示剂,不能用试纸测氯水的pH,D错误;故选B。5.周期表中ⅥA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;2HS是第3页/共19页(北京)股份有限公司一种易燃的有毒气体(燃烧热为-1562.2kJmol),可制取各种硫化物:硫酸、硫酸盐是重要化工原料;硫酰氯(22SOCl)是重要的化工试剂,常作氯化剂或氯磺化剂。硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原料回收Se,以电解强碱性23NaTeO,溶液制备Te。下列说法正确的是A.22HO是非极性分子B.3SO与23SO微粒中的O-S-O夹角相等C.硒原子基态核外价电子排布式为244s4pD.ⅥA族元素氢化物的熔沸点从上到下依次增大【答案】C【解析】【详解】A.22HO结构不对称,是极性分子,故A错误;B.3SO是平面结构,23SO是三角锥形,微粒中的O-S-O夹角不相等,故B错误;C.硒是第四周期ⅥA族元素,硒原子是基态核外价电子排布式为244s4p,故C正确;D.ⅥA族元素氢化物中,H2O分子间能形成氢键,水的熔沸点最高,故D错误;选C。6.周期表中ⅥA族元素及其化合物应用广泛。用硫磺熏蒸中药材的传统由来已久;2HS是一种易燃的有毒气体(燃烧热为-1562.2kJmol),可制取各种硫化物:硫酸、硫酸盐是重要化工原料;硫酰氯(22SOCl)是重要的化工试剂,常作氯化剂或氯磺化剂。硒(34Se)和碲(52Te)的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,工业上以精炼铜的阳极泥(含CuSe)为原...