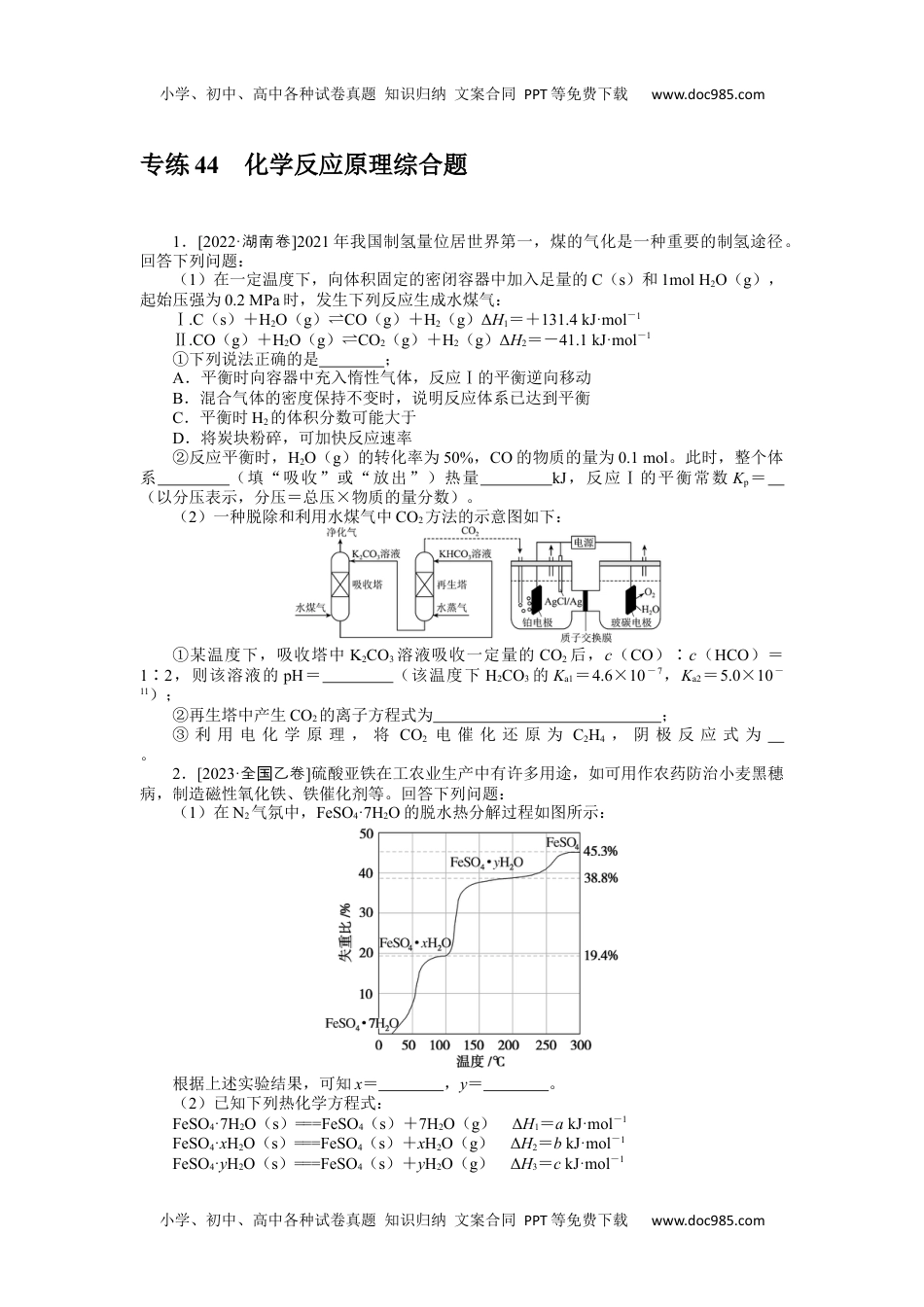
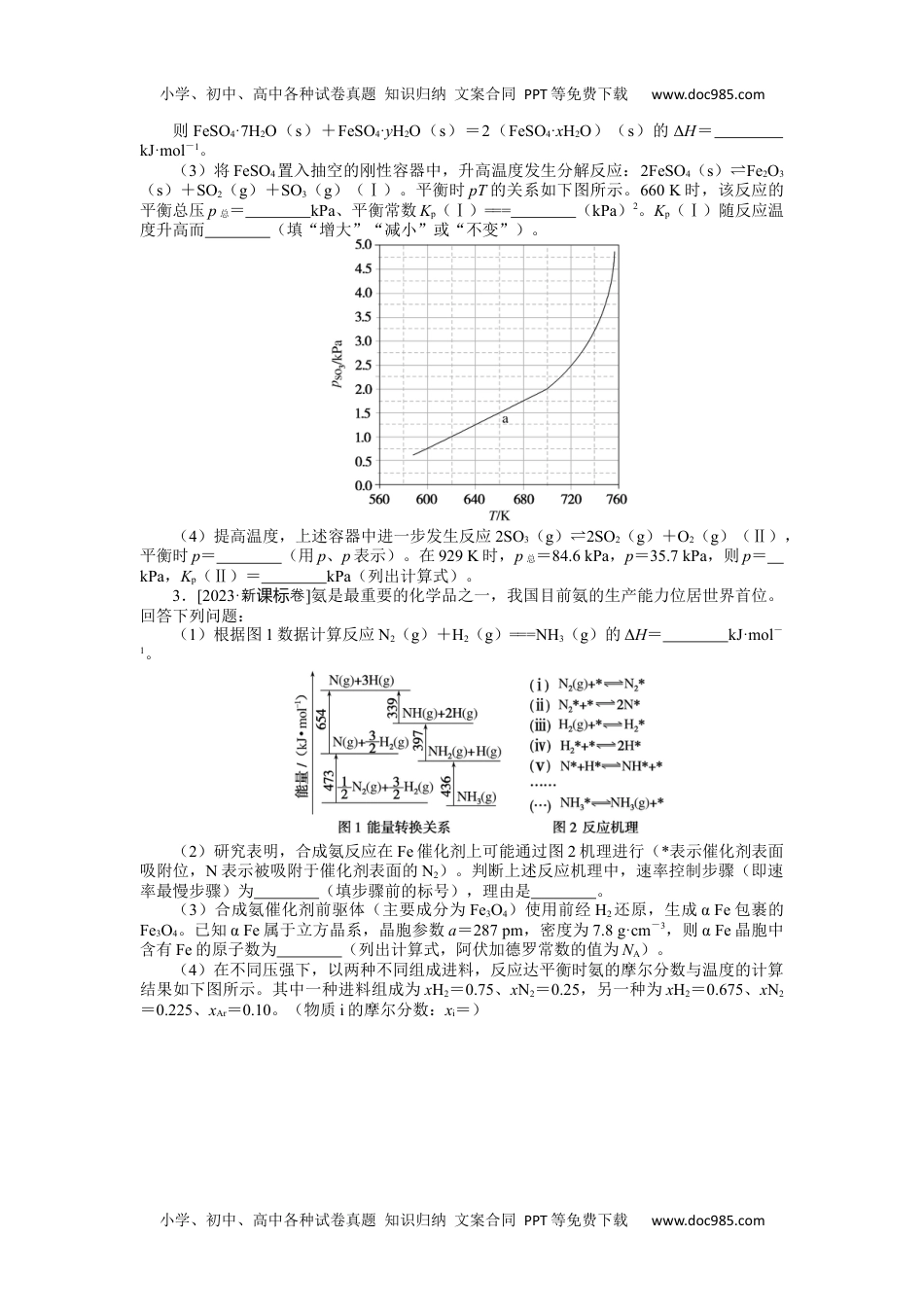
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com专练44化学反应原理综合题1.[2022·湖南卷]2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:(1)在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1molH2O(g),起始压强为0.2MPa时,发生下列反应生成水煤气:Ⅰ.C(s)+H2O(g)⇌CO(g)+H2(g)ΔH1=+131.4kJ·mol-1Ⅱ.CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH2=-41.1kJ·mol-1①下列说法正确的是;A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动B.混合气体的密度保持不变时,说明反应体系已达到平衡C.平衡时H2的体积分数可能大于D.将炭块粉碎,可加快反应速率②反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1mol。此时,整个体系(填“吸收”或“放出”)热量kJ,反应Ⅰ的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。(2)一种脱除和利用水煤气中CO2方法的示意图如下:①某温度下,吸收塔中K2CO3溶液吸收一定量的CO2后,c(CO)∶c(HCO)=1∶2,则该溶液的pH=(该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11);②再生塔中产生CO2的离子方程式为;③利用电化学原理,将CO2电催化还原为C2H4,阴极反应式为。2.[2023·全乙卷国]硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:(1)在N2气氛中,FeSO4·7H2O的脱水热分解过程如图所示:根据上述实验结果,可知x=,y=。(2)已知下列热化学方程式:FeSO4·7H2O(s)===FeSO4(s)+7H2O(g)ΔH1=akJ·mol-1FeSO4·xH2O(s)===FeSO4(s)+xH2O(g)ΔH2=bkJ·mol-1FeSO4·yH2O(s)===FeSO4(s)+yH2O(g)ΔH3=ckJ·mol-1小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com则FeSO4·7H2O(s)+FeSO4·yH2O(s)=2(FeSO4·xH2O)(s)的ΔH=kJ·mol-1。(3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s)⇌Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时pT的关系如下图所示。660K时,该反应的平衡总压p总=kPa、平衡常数Kp(Ⅰ)===(kPa)2。Kp(Ⅰ)随反应温度升高而(填“增大”“减小”或“不变”)。(4)提高温度,上述容器中进一步发生反应2SO3(g)⇌2SO2(g)+O2(g)(Ⅱ),平衡时p=(用p、p表示)。在929K时,p总=84.6kPa,p=35.7kPa,则p=kPa,Kp(Ⅱ)=kPa(列出计算式)。3.[2023·新卷课标]氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)根据图1数据计算反应N2(g)+H2(g)===NH3(g)的ΔH=kJ·mol-1。(2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成αFe包裹的Fe3O4。已知αFe属于立方晶系,晶胞参数a=287pm,密度为7.8g·cm-3,则αFe晶胞中含有Fe的原子数为(列出计算式,阿伏加德罗常数的值为NA)。(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为xH2=0.75、xN2=0.25,另一种为xH2=0.675、xN2=0.225、xAr=0.10。(物质i的摩尔分数:xi=)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com①图中压强由小到大的顺序为,判断的依据是。②进料组成中含有惰性气体Ar的图是。③图3中,当p2=20MPa、xNH3=0.20时,氮气的转化率α=。该温度时,反应N2(g)+H2(g)⇌NH3(g)的平衡常数Kp=(MPa)-1(化为最简式)。4.[2022·浙江卷1月()节选]工业上,以煤炭为...