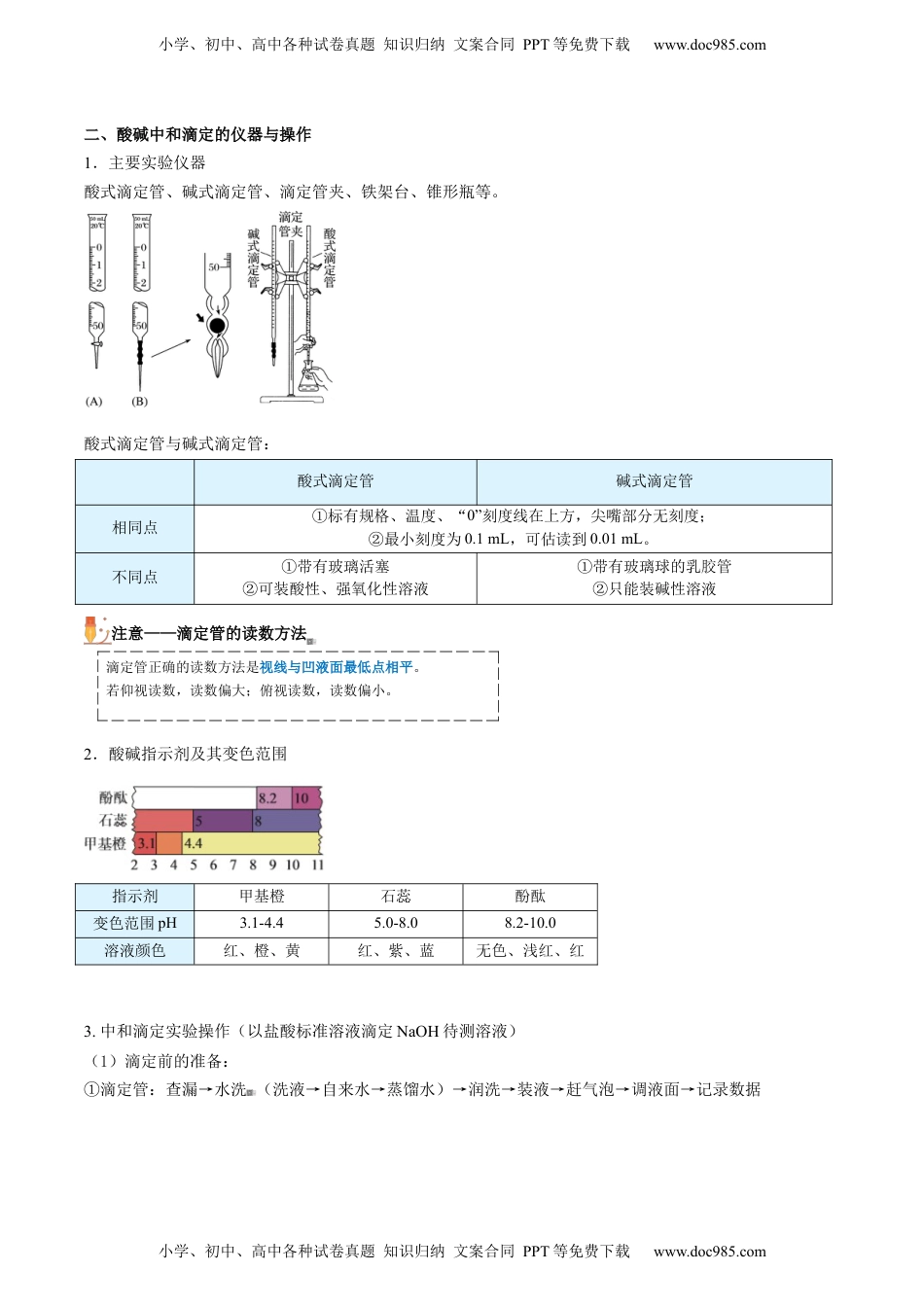
第18讲酸碱中和滴定知识导航知识精讲小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com课前引入化学实验室里,一瓶氢氧化钠溶液的标签被腐蚀,看不清其浓度。你有办法测出其浓度吗?一、酸碱中和滴定的概念和原理1.概念:利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的浓度的实验方法。2.原理:H++OH-===H2O,中和反应中H+与OH-的物质的量相等,即c(H+)·V(H+)=c(OH-)·V(OH-)。3.待测液的浓度计算:c待测=注意准确判断滴定终点,以及读取标准液的体积是关键。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com二、酸碱中和滴定的仪器与操作1.主要实验仪器酸式滴定管、碱式滴定管、滴定管夹、铁架台、锥形瓶等。酸式滴定管与碱式滴定管:酸式滴定管碱式滴定管相同点①标有规格、温度、“0”刻度线在上方,尖嘴部分无刻度;②最小刻度为0.1mL,可估读到0.01mL。不同点①带有玻璃活塞②可装酸性、强氧化性溶液①带有玻璃球的乳胶管②只能装碱性溶液注意——滴定管的读数方法滴定管正确的读数方法是视线与凹液面最低点相平。若仰视读数,读数偏大;俯视读数,读数偏小。2.酸碱指示剂及其变色范围指示剂甲基橙石蕊酚酞变色范围pH3.1-4.45.0-8.08.2-10.0溶液颜色红、橙、黄红、紫、蓝无色、浅红、红3.中和滴定实验操作(以盐酸标准溶液滴定NaOH待测溶液)(1)滴定前的准备:①滴定管:查漏→水洗(洗液→自来水→蒸馏水)→润洗→装液→赶气泡→调液面→记录数据小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com排气泡方法:调节滴定管活塞,排出尖嘴部分的气泡,使其充满反应液(除去碱式滴定管乳胶管中气泡的方法如下图所示),如果滴定管内部有气泡,应快速放液以赶走气泡。②锥形瓶:水洗→装液→加指示剂③指示剂的选择:一般不选择石蕊,变色现象不明显。强酸滴(弱)碱甲基橙,强碱滴(弱)酸用酚酞,两强互滴(甲基橙酚酞)都可以。(2)滴定:边滴边振荡→滴速先快后慢→左手控制滴定管活塞,且结束前不能离开,右手摇动锥形瓶,眼睛注视锥形瓶内溶液变化→判定终点→读数(等1-2min液面稳定后)(3)终点判断当滴入半滴标准液,指示剂变色,且在半分钟内不变色,视为滴定终点。(4)数据处理:为减少实验误差,重复实验2~3次,求所用标准液体积的平均值,计算待测液的浓度c待测=。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com4.酸碱中和滴定曲线以标准液体积为横坐标,以pH为纵坐标,作图(以HCl滴定NaOH为例)开始时由于待测液的浓度较大,加入少量的标准液对其pH影响不大。当接近滴定终点(pH=7)时,很少量(0.04mL,约一滴)的碱或酸就会引起溶液pH突变。三、酸碱中和滴定的误差分析由c待测=可知,c标准和V待测均为定值,所以c待测的误差主要来自V标准,V标准偏大则c待测偏高,V标准偏小则c待测偏低。(1)若以盐酸标准液滴定未知浓度的NaOH溶液,常见的误差分析如下:步骤操作V标准c待测洗涤酸式滴定管未用标准溶液润洗变大偏高碱式滴定管未用标准溶液润洗变小偏低锥形瓶用待测溶液润洗变大偏高锥形瓶洗净后还留有蒸馏水不变无影响取液放出碱液的滴定管开始有气泡,放出液体后气泡消失变小偏低滴定酸式滴定管滴定前有气泡,滴定终点时气泡消失变大偏高振荡锥形瓶时部分液体溅出变小偏低部分酸液滴出锥形瓶外变大偏高溶液颜色较浅时滴入酸液过快,停止滴定后再加一滴NaOH溶液无变化变大偏高读数滴定前读数正确,滴定后俯视读数(或前仰后俯)变小偏低滴定前读数正确,滴定后仰视读数(或前俯后仰)变大偏高明辨是非小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(1)滴定终点就是酸碱恰好中和的点____...