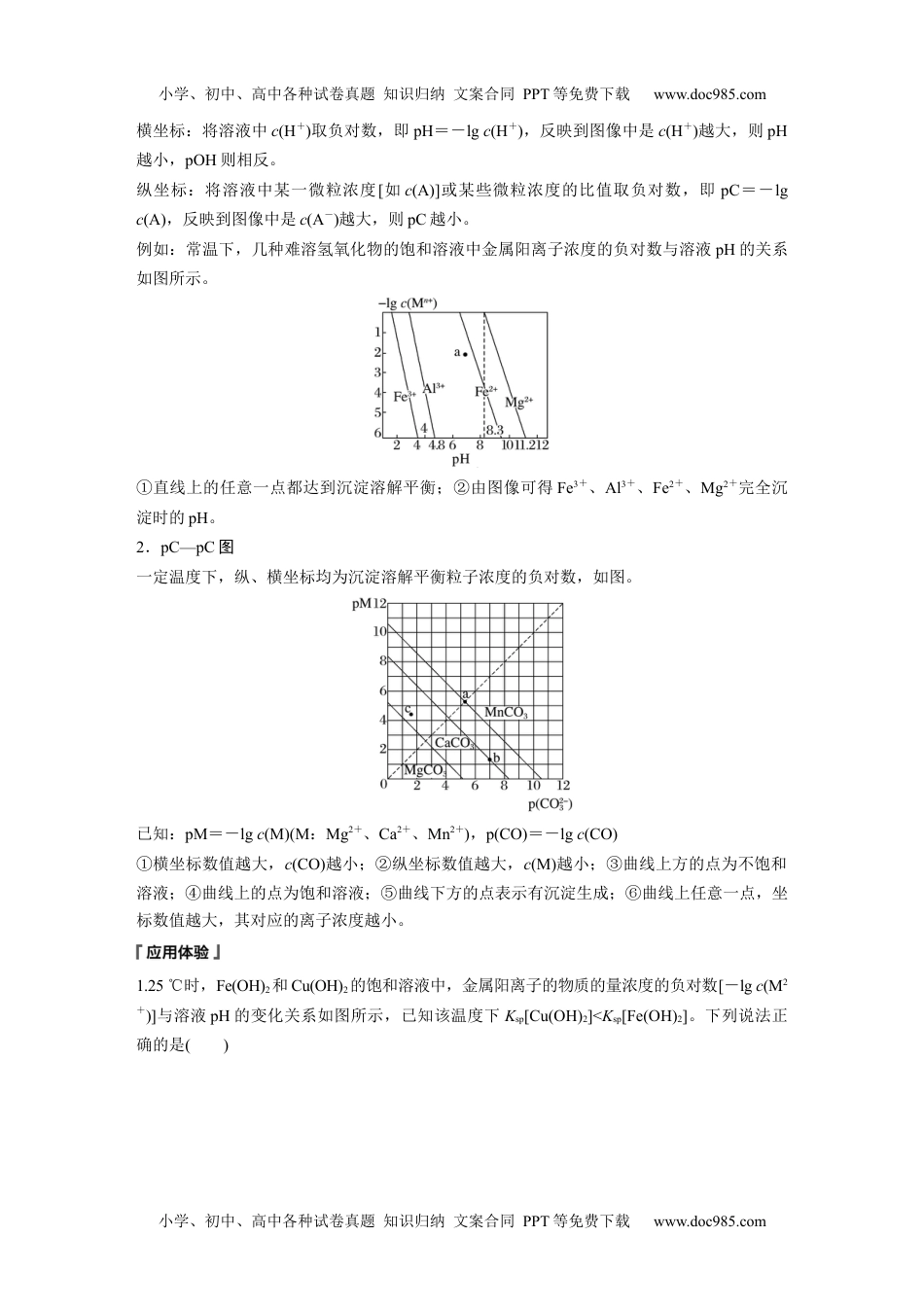
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第4课时难溶电解质沉淀溶解平衡图像分析[核心素养发展目标]1.理解难溶电解质沉淀溶解平衡并会应用解决相关问题。2.学会沉淀溶解平衡图像的分析方法。一、曲线型图像1.沉淀溶解平衡Ksp曲线(1)典型示例(2)点的变化①a→c:曲线上变化,增大c(SO);②b→c:加入1×10-5mol·L-1Na2SO4溶液(加水不行);③d→c:加入BaCl2固体(忽略溶液的体积变化);④c→a:曲线上变化,增大c(Ba2+);⑤曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液。2.c(Mn+)—pH图像Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):图中曲线为相应金属阳离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的Ksp的大小以及离子分离方法的选择。1.(2022·高二青岛检测)一定温度下,AgCl(s)Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是()小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等2.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是()A.Ksp<KspB.加适量NH4Cl固体可使溶液由a点变到b点C.c、d两点代表的溶液中c与c乘积相等D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和3.如图所示,有两条T1、T2两种温度下的BaSO4在水中的沉淀溶解平衡曲线,下列说法不正确的是()A.加入Na2SO4固体可使溶液由a点变到b点B.T1温度下,在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)D.升温可使溶液由b点变为d点二、对数型图像1.pH(或pOH)—pC图小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com横坐标:将溶液中c(H+)取负对数,即pH=-lgc(H+),反映到图像中是c(H+)越大,则pH越小,pOH则相反。纵坐标:将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lgc(A),反映到图像中是c(A-)越大,则pC越小。例如:常温下,几种难溶氢氧化物的饱和溶液中金属阳离子浓度的负对数与溶液pH的关系如图所示。①直线上的任意一点都达到沉淀溶解平衡;②由图像可得Fe3+、Al3+、Fe2+、Mg2+完全沉淀时的pH。2.pC—pC图一定温度下,纵、横坐标均为沉淀溶解平衡粒子浓度的负对数,如图。已知:pM=-lgc(M)(M:Mg2+、Ca2+、Mn2+),p(CO)=-lgc(CO)①横坐标数值越大,c(CO)越小;②纵坐标数值越大,c(M)越小;③曲线上方的点为不饱和溶液;④曲线上的点为饱和溶液;⑤曲线下方的点表示有沉淀生成;⑥曲线上任意一点,坐标数值越大,其对应的离子浓度越小。1.25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是()小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.comA.曲线a表示Fe(OH)2饱和溶液中的变化关系B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuOC.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液2.某硫酸盐在水中的沉淀溶解平衡曲线如下(M2+代表+2价金属离子)。下列说法正确的是()A.363K时,该硫酸盐的溶度积Ksp的数量级为10-3B.温度一定时溶度积Ksp随c(SO)的增大而减小C.313K下的该盐饱和溶液升温到363K时有固体析出D.283K下的该盐饱和溶...