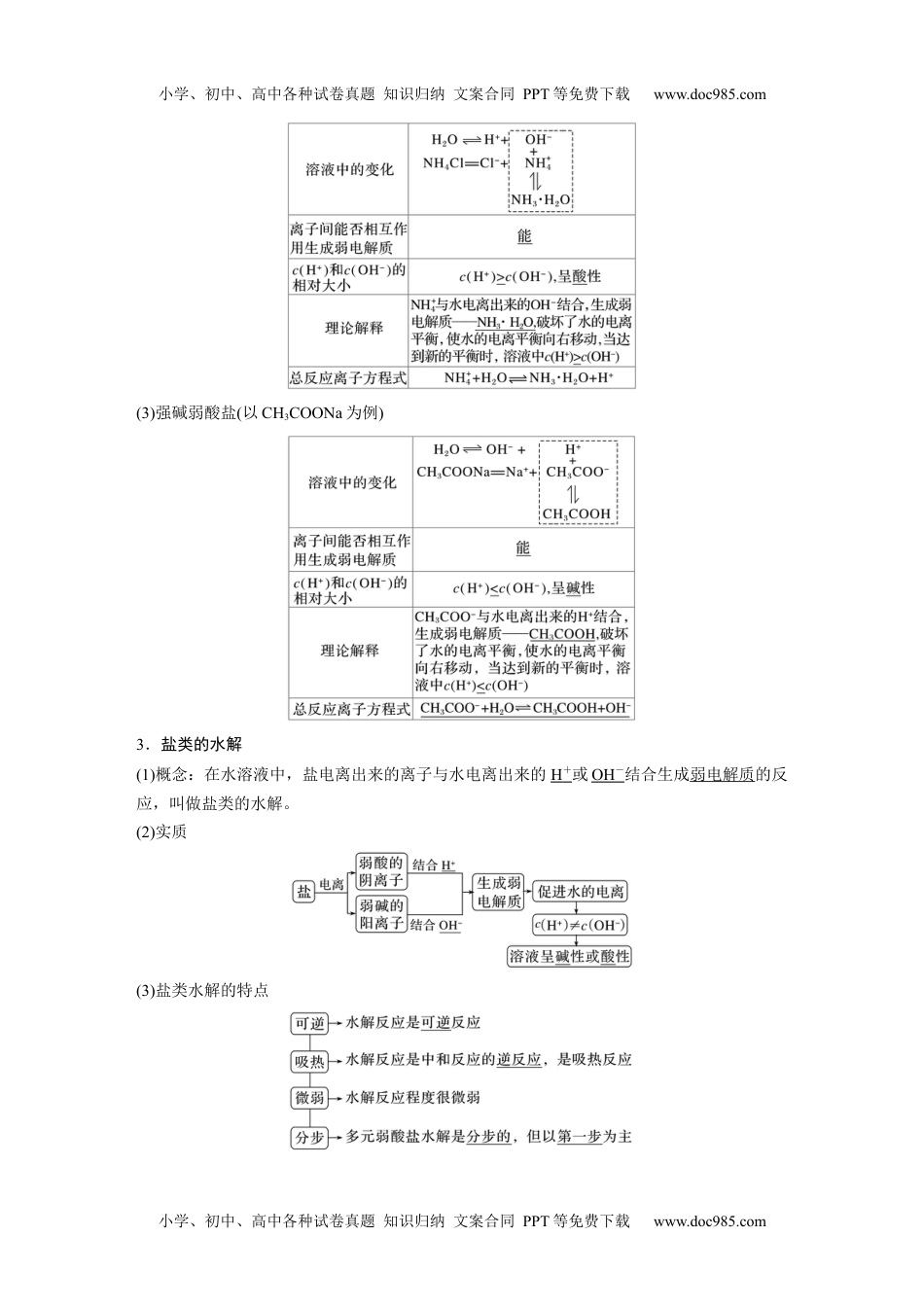
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第三节盐类的水解第1课时盐类的水解[核心素养发展目标]1.通过实验探究盐溶液的酸碱性,掌握盐的类型与其溶液酸碱性的关系。2.能分析盐溶液呈现不同酸碱性的原因,掌握盐类水解的原理及盐溶液呈现不同酸碱性的规律。3.理解盐类水解的概念,认识盐类水解有一定限度,能正确书写盐类水解的离子方程式和化学方程式。一、盐溶液的酸碱性及原因1.探究盐溶液的酸碱性常温下用pH计测定下列溶液的pH,并按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完成下表。盐溶液pH盐的类型酸碱性NaClpH=7强酸强碱盐中性Na2SO4pH=7Na2CO3pH>7强碱弱酸盐碱性NaHCO3pH>7CH3COONapH>7FeCl3pH<7强酸弱碱盐酸性(NH4)2SO4pH<72.理论分析盐溶液呈酸碱性的原因(1)强酸强碱盐(以NaCl为例)溶液中的变化H2OH++OH-NaCl===Na++Cl-离子间能否相互作用生成弱电解质否c(H+)和c(OH-)的相对大小c(H+)=c(OH-),呈中性,无弱电解质生成理论解释水的电离平衡不发生移动,溶液中c(H+)=c(OH-)(2)强酸弱碱盐(以NH4Cl为例)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(3)强碱弱酸盐(以CH3COONa为例)3.盐类的水解(1)概念:在水溶液中,盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。(2)实质(3)盐类水解的特点小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com4.盐类水解的规律(1)有弱才水解——必须含有弱酸或弱碱的离子才能发生水解。(2)无弱不水解——强酸强碱盐不发生水解。常见不水解的离子:①强酸阴离子:Cl-、SO、NO、Br-、I-、ClO;②强碱阳离子:K+、Na+、Ca2+、Ba2+。(3)谁弱谁水解——发生水解的是弱碱阳离子或弱酸阴离子。(4)谁强显谁性——组成盐的酸根离子(碱的阳离子)是强酸根离子(强碱的阳离子),则显酸(碱)性。(5)都弱都水解——弱酸弱碱盐因阴、阳离子都能发生水解且两水解过程可相互促进,所以水解程度较大,少数可以完全水解。(6)同强显中性——①强酸强碱盐溶液显中性;②盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液呈中性,如CH3COONH4溶液呈中性。(7)越弱越水解——组成盐的酸根离子对应的酸(即水解生成的酸)酸性越弱(或阳离子对应的碱的碱性越弱),水解程度就越大,此即“越弱越水解”规律。电离程度:CH3COOH>H2CO3>HCN>HCO,水解程度:CH3COO-<HCO<CN-<CO。(1)酸式溶液可能呈酸性,也可能呈性盐碱()(2)某溶液呈酸性,一定生了水解反盐该盐发应()(3)常下,温pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的离程度相同电()(4)CH3COONH4水溶液呈中性,溶液中的c(H+)=c(OH-)()答案(1)√(2)×(3)√(4)√1.怎样用最简单的方法区别NaCl溶液、NH4Cl溶液和Na2CO3溶液?提示三溶液各取少于管中,分滴入紫色石蕊溶液,溶液不色的将种许试别变为NaCl溶液,色的变红为NH4Cl溶液,色的变蓝为Na2CO3溶液。2.怎样证明Na2CO3溶液呈碱性是由CO水解引起的?提示向Na2CO3溶液中滴入溶液,溶液色;若再向溶液中滴入量化溶液酚酞显红该过氯钙,生白色沉淀,且溶液的色褪去,可明产红说Na2CO3溶液呈性是由碱CO水解引起的。3.已知常温下HF和CH3COOH的电离常数分别为6.3×10-4、1.75×10-5,试判断等浓度的NaF和CH3COONa溶液pH的大小。提示依据越弱越水解判,断CH3COONa溶液的pH大于NaF溶液的pH。小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com1.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是()A.HX、HZ、HYB.HX、HY、HZC.HZ、HY、HXD.HY、HZ、HX答案B解析利用水解律盐类规“越弱越水解,强性谁显谁”,合同度三酸的的溶结浓种对应钠盐液的pH可推...