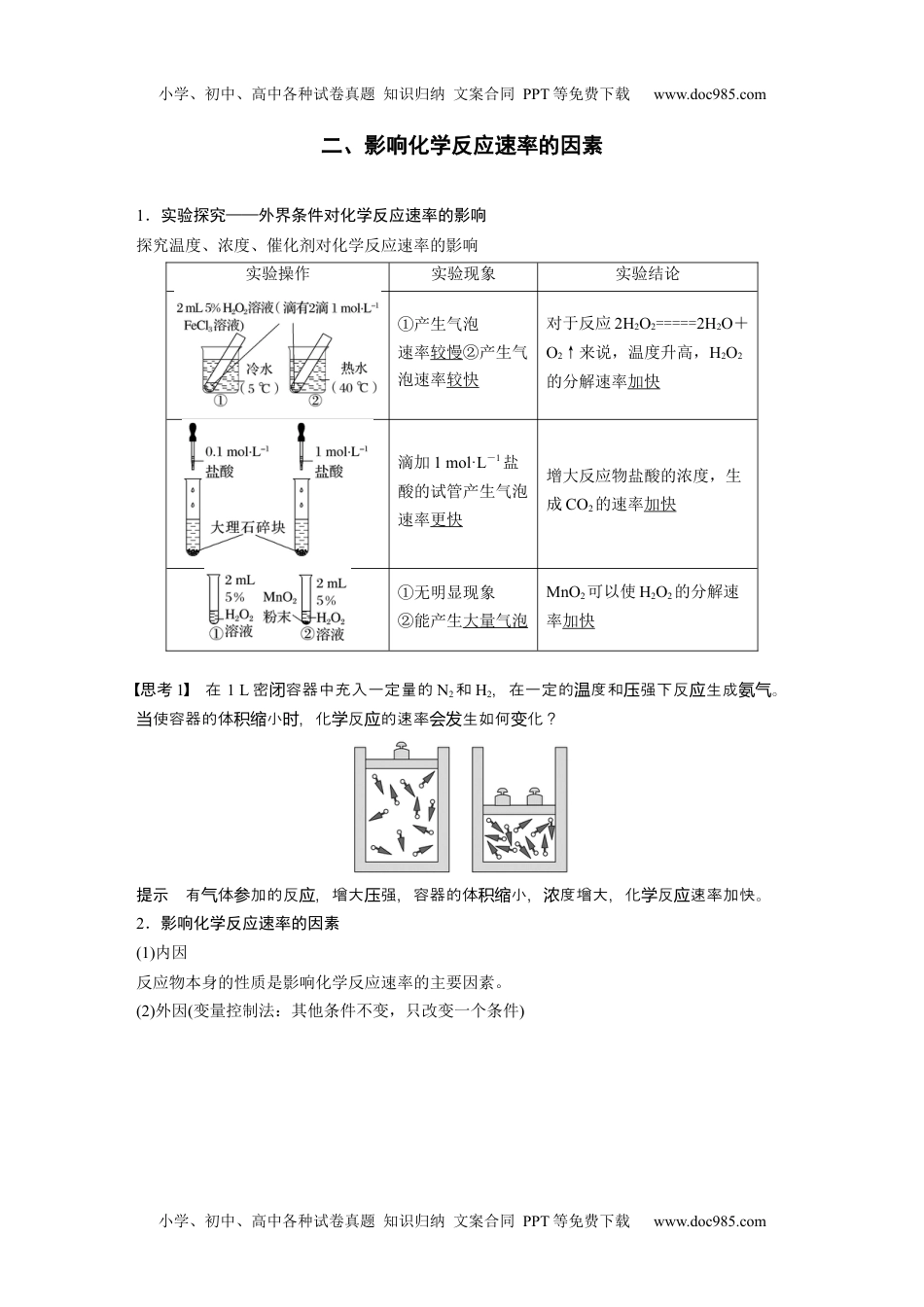
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第二节化学反应的速率与限度第1课时化学反应的速率[核心素养发展目标]1.了解化学反应速率的概念和表示方法,并能进行简单计算。2.理解影响化学反应速率的因素及规律,并能合理解释生产、生活中的相关化学现象。3.学会运用变量控制研究影响化学反应速率的方法。一、化学反应速率及其表示方法化学反应速率例已知合成氨反应N2(g)+3H2(g)2NH3(g),其浓度数据如下:N2H2NH3起始浓度/(mol·L-1)1.03.002s末浓度/(mol·L-1)0.61.80.82s内,N2、H2、NH3的物质的量浓度变化各为多少?则2s内用N2、H2、NH3表示的化学反应速率v(N2)、v(H2)、v(NH3)分别为多少?提示2s,内Δc(N2)=(1.0-0.6)mol·L-1=0.4mol·L-1,Δc(H2)=(3.0-1.8)mol·L-1=1.2mol·L-1,Δc(NH3)=(0.8-0)mol·L-1=0.8mol·L-1,2s内v(N2)===0.2mol·L-1·s-1,v(H2)===0.6mol·L-1·s-1,v(NH3)===0.4mol·L-1·s-1。思考根据上述算,同一反在相同,用不同物表示的反速率,其是否计应时间内质应数值相同?表示的反快慢是否相同?用不同物表示同一反的反速率其有什律?应质应应数值么规小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com提示同一反在相同,用不同物表示的反速率,其可能不同,但都表示应时间内质应数值该反的反速率,意相同;用不同物表示化反速率,化反速率之比等于其化应应义质学应时学应量之比。学计数1.判断正误(1)对于任何化学反应来说,反应速率越大,反应现象就越明显()(2)对有固体参加的化学反应,可用单位时间内固体浓度的改变量表示化学反应速率()(3)化学反应速率的单位通常为mol·s-1或mol·min-1()(4)反应速率是指某反应在某时刻的瞬时速率()答案(1)×(2)×(3)×(4)×2.已知反应4CO(g)+2NO2(g)=====N2(g)+4CO2(g)在不同条件下的化学反应速率如下:①v(CO)=1.5mol·L-1·min-1②v(NO2)=0.01mol·L-1·s-1③v(N2)=0.4mol·L-1·min-1④v(CO2)=1.1mol·L-1·min-1请比较上述4种情况反应的快慢:_______________(由大到小的顺序)。答案③①②④解析②化可表示经转为v(CO)=2v(NO2)=0.02mol·L-1·s-1=1.2mol·L-1·min-1;③v(CO)=4v(N2)=1.6mol·L-1·min-1;④v(CO)=v(CO2)=1.1mol·L-1·min-1。1.对化学反应速率的理解2.化学反应速率大小的比较方法(1)一法:若位不一,要算成相同的位;若不同物表示的反速率,要归单统则换单为质应则算成同一物表示反速率,再比的大小。换质来应较数值(2)比法:比化反速率化量的比,如值较学应与学计数值aA(g)+bB(g)===cC(g)+dD(g),比,若>,明用较与则说A表示的化反速率大于用学应B表示的化反速率。学应小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com二、影响化学反应速率的因素1.实验探究——外界条件对化学反应速率的影响探究温度、浓度、催化剂对化学反应速率的影响实验操作实验现象实验结论①产生气泡速率较慢②产生气泡速率较快对于反应2H2O2=====2H2O+O2↑来说,温度升高,H2O2的分解速率加快滴加1mol·L-1盐酸的试管产生气泡速率更快增大反应物盐酸的浓度,生成CO2的速率加快①无明显现象②能产生大量气泡MnO2可以使H2O2的分解速率加快思考1在1L密容器中充入一定量的闭N2和H2,在一定的度和强下反生成。温压应氨气使容器的体小,化反的速率生如何化?当积缩时学应会发变提示有体加的反,增大强,容器的体小,度增大,化反速率加快。气参应压积缩浓学应2.影响化学反应速率的因素(1)内因反应物本身的性质是影响化学反应速率的主要因素。(2)外因(变量控制法:其他条件不变,只改变一个条件)小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com思考2下列象体了些影化反速率的因素?现...