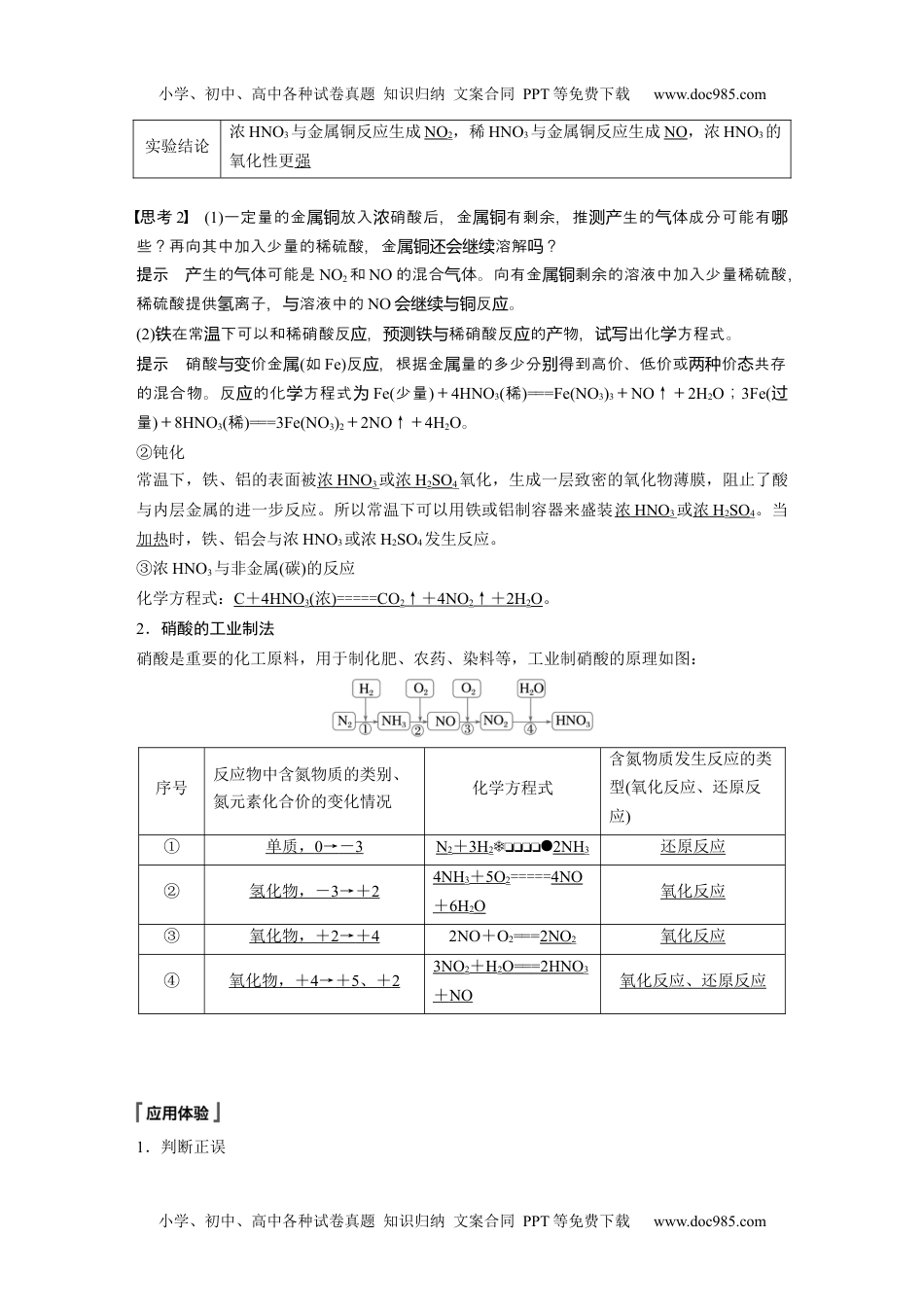
小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com第4课时硝酸酸雨及防治[核心素养发展目标]1.掌握硝酸的性质及应用。2.知道酸雨的成因及防治措施。3.掌握硝酸与金属、非金属反应的特点。一、硝酸的性质及工业制法1.硝酸的性质硝酸是无色、易挥发、有刺激性气味的液体,硝酸具有如下化学性质:(1)不稳定性浓硝酸见光或受热易分解,化学方程式为4HNO3=====4NO2↑+O2↑+2H2O。长期存放的浓硝酸呈黄色是因为其分解生成的NO2溶于硝酸中,实验室常将浓硝酸保存在棕色试剂瓶中,并放置在阴凉处。(2)酸性硝酸是强酸,具有酸的通性。写出下列反应的离子方程式:①硝酸和氢氧化钠反应:H++OH-===H2O。②硝酸和氧化钠反应:2H++Na2O===2Na++H2O。③硝酸和碳酸钙反应:2H++CaCO3===Ca2++CO2↑+H2O。思考1若把硝酸滴加到石蕊溶液中,溶液先后褪色,出象的原因是什?变红现该现么提示硝酸酸性使石蕊溶液,因强化性而具有漂白性,又使其褪色。显变红氧(3)强氧化性①硝酸具有很强的氧化性,浓度不同,与金属反应的产物也不同。实验探究:浓HNO3和稀HNO3与铜的反应实验装置两只具支试管中分别加入浓硝酸和稀硝酸实验现象浓HNO3:铜丝变细,产生大量红棕色气体,溶液逐渐变绿稀HNO3:铜丝变细,开始产生少量无色气体,反应逐渐加快,气体在试管上部变为红棕色,溶液逐渐变蓝化学方程式Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com实验结论浓HNO3与金属铜反应生成NO2,稀HNO3与金属铜反应生成NO,浓HNO3的氧化性更强思考2(1)一定量的金放入硝酸后,金有剩余,推生的体成分可能有属铜浓属铜测产气哪些?再向其中加入少量的稀硫酸,金溶解?属铜还会继续吗提示生的体可能是产气NO2和NO的混合体。向有金剩余的溶液中加入少量稀硫酸气属铜,稀硫酸提供离子,溶液中的氢与NO反。会继续与铜应(2)在常下可以和稀硝酸反,稀硝酸反的物,出化方程式。铁温应预测铁与应产试写学提示硝酸价金与变属(如Fe)反,根据金量的多少分得到高价、低价或价共存应属别两种态的混合物。反的化方程式应学为Fe(少量)+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;3Fe(过量)+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2O。②钝化常温下,铁、铝的表面被浓HNO3或浓H2SO4氧化,生成一层致密的氧化物薄膜,阻止了酸与内层金属的进一步反应。所以常温下可以用铁或铝制容器来盛装浓HNO3或浓H2SO4。当加热时,铁、铝会与浓HNO3或浓H2SO4发生反应。③浓HNO3与非金属(碳)的反应化学方程式:C+4HNO3(浓)=====CO2↑+4NO2↑+2H2O。2.硝酸的工业制法硝酸是重要的化工原料,用于制化肥、农药、染料等,工业制硝酸的原理如图:序号反应物中含氮物质的类别、氮元素化合价的变化情况化学方程式含氮物质发生反应的类型(氧化反应、还原反应)①单质,0→-3N2+3H22NH3还原反应②氢化物,-3→+24NH3+5O2=====4NO+6H2O氧化反应③氧化物,+2→+42NO+O2===2NO2氧化反应④氧化物,+4→+5、+23NO2+H2O===2HNO3+NO氧化反应、还原反应1.判断正误小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com小学、初中、高中各种试卷真题知识归纳文案合同PPT等免费下载www.doc985.com(1)硝酸可与Na2SO3反应生成SO2()(2)稀硝酸可溶解Fe(OH)2生成Fe(NO3)2和水()(3)碳、铜与浓硝酸反应时,浓硝酸只表现强氧化性()(4)在常温下Fe和Al在浓硫酸和浓硝酸中发生钝化,说明常温下浓硫酸和浓硝酸与Fe和Al不反应()(5)王水是浓硝酸和浓盐酸体积比为1∶3的混合物,其氧化性比浓硝酸强()答案(1)×(2)×(3)×(4)×(5)√2.下列事实与硝酸性质的对应关系错误的是()A.打开浓硝酸的试剂瓶,瓶口有白雾——挥发性B.用棕色试剂瓶保存浓硝酸——不稳定性C.稀硝酸使紫色石蕊溶液变红——酸性D.稀硝酸使黑色氧化铜固体溶解——强氧化性答案D解析硝酸具有性,出浓挥发挥发HNO3(g)溶于水蒸中生白,气产雾A正确;HNO3光...